

(i)我々の最近の研究成果(ウイルス側)
(1)ノダウイルスとは?
(2)ノダウイルスのモデルウイルスとしての特徴
(3)ノダウイルスの宿主特異性決定機構
(4)ノダウイルスの温度感受性決定機構
(5)ノダウイルスB2タンパク質によるRNAi機構の抑制
(1)ノダウイルスとは?
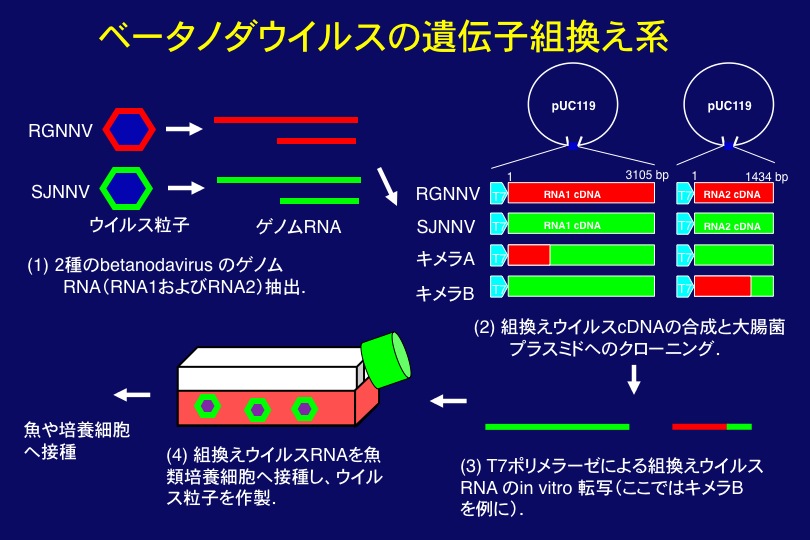
ウイルス性神経壊死症は様々な魚類の主に仔稚魚期に発生し、高い死亡率をもたらすことから水産増養殖上大きな問題となっている(図1)。本病の原因体であるベータノダウイルスは、エンベロープを持たない小型球形RNAウイルスで、ゲノムはRNA1(3.1 kb)およびRNA2(1.4 kb)の分節ゲノムからなり、それぞれprotein A(ウイルスRNA複製酵素)、CP(外被タンパク質)をコードする(図2)。また、ウイルス増殖中にはサブゲノムであるRNA3を合成し、それはproteinB2をコードする。我々の研究で、RNA1は本ウイルスの温度感受性に、RNA2は宿主特異性と温度感受性に、そしてRNA3はRNA干渉のサプレッサーをコードすることが判明した(図2;詳細は後述)。
 |
 |
| 図 1 | 図 2 |
(2)ノダウイルスのモデルウイルスとしての特徴
ベータノダウイルスは、ゲノムサイズが小さく、培養上清からは高力価のウイルスが得られ、遺伝子組換え系が利用でき(図3)、またモデル魚であるメダカに感染することから、感染増殖メカニズムを解明するための格好の材料である(図4)。また、本ウイルスはRNAウイルスとしては自然突然変異が起きにくいのも特徴である。
 |
 |
| 図 3 | 図 4 |
(3)ノダウイルスの宿主特異性決定機構
ベータノダウイルスは外被タンパク質遺伝子の多型領域の比較により、4タイプ(RGNNV、SJNNV、TPNNV、BFNNV)に大別される(図5)。各遺伝子型のウイルス株はそれぞれユニークな宿主から分離されており(図6)、本ウイルスには宿主特異性があることが示唆されてはいたが証明されていなかった。
そこで我々は、シマアジおよびマハタに感染するSJNNVおよびRGNNVを用い、分節ゲノムを交換したリアソータントウイルスがどのような特異性を示すかを浸漬感染実験(図7)により確認した。その結果、ウイルスがRGNNV RNA2を持てばマハタに感染し、SJNNV RNA2を持てばシマアジに感染することが判明した(図8)。
次に、RNA2のどの部分が宿主特異性決定に重要かを確かめるため、キメラRNA2を有する組換えウイルスを作製し、それらの特異性を同様に検討した。その結果、ベータノダウイルスの遺伝子型決定に利用されてきたRNA2の多型領域が宿主特異性を決定するのに十分であることが判明した(図9,10)。
 |
 |
| 図 5 | 図 6 |
 |
 |
| 図 7 | 図 8 |
 |
 |
| 図 9 | 図 10 |
(4)ノダウイルスの温度感受性決定機構
各遺伝子型ウイルスの至適増殖温度は、RGNNV(20-30°C)、SJNNV(20-25°C)、TPNNV(20°C)およびBFNNV(15-20°C)であり、分離宿主の至適生育温度とほぼ一致する(図11)。しかしながら、ベータノダウイルスの温度感受性メカニズムについては一切分かっていなかった。
そこで我々は、まずRNA1、RNA2のどちらのゲノムが温度感受性を支配するかを調べるため、RGNNV、SJNNVおよびそのリアソータントウイルスを用い、培養細胞への感染実験を行った。その結果、RNA1およびRNA2の両方が温度感受性決定に関与することが判明した(図12)。
温度は細胞内におけるウイルスRNA複製レベルに影響した(図13)。そこで、複製酵素をコードするRNA1を分離精製して培養細胞にトランスフェクションし、RNA1の単独複製への温度の影響を調べた。その結果、SJNNV RNA1は25℃では複製するが30℃では複製せず、温度がRNA1に影響し、ウイルスRNA複製を制御することが判明した(図14)。
そこで、次にRNA1のどの領域が温度感受性決定に重要かを確認するため、キメラRNA2を有する組換えウイルスを作製し、それらの25℃および30℃における増殖性を調べた。その結果、protein Aのアミノ酸残基1-445をコードするRNA1領域が温度感受性には重要であることが判明した(図15)。この領域はprotein A がミトコンドリア膜に局在する際に重要な配列を含み、酵素の活性中心を含んでいないことから、温度はprotein
Aの立体構造や局在性に影響を与えているのかもしれない。
残るRNA2はウイルス感染増殖過程のどこに影響するのであろうか。これを確認するため、まずRGNNV、SJNNVおよびそのリアソータントウイルスの粒子を30℃で5日間インキュベートし、ウイルス粒子の安定性を調べた。その結果、各ウイルスの力価は僅かにしか低下せず、その差も高々2,3倍であり(図16)、ウイルス粒子の安定性がウイルスの温度感受性に大きく影響するとは考えにくかった。
最後に、ウイルス粒子の細胞への吸着過程に温度が影響するかをRGNNV、SJNNVおよびそのリアソータントを用いて検討した。その結果、各ウイルスの細胞への吸着度は異なっていたが、温度が吸着度に影響することはなかった(図17)。
これらをまとめると、RNA1はウイルスRNA複製に、RNA2は脱殻、RNA複製あるいは粒子化に影響している可能性が示唆される(図18)。この検証は今後の検討課題である。
 |
 |
| 図 11 | 図 12 |
 |
 |
| 図 13 | 図 14 |
 |
 |
| 図 15 | 図 16 |
 |
 |
| 図 17 | 図 18 |
(5)ノダウイルスB2タンパク質によるRNAi機構の抑制
ベータノダウイルスはRNA複製過程で2本鎖RNAを形成する。2本鎖RNAはRNA干渉作用の誘導物質であり、ベータノダウイルスがRNA干渉作用のサプレッサーをコードしていることが予測された。そこで、唯一機能の不明であったRNA3がコードするprotein B2にその機能があるかを調べた。
方法は、まずGFP遺伝子を恒常的に発現する組換え植物(タバコ)を作製し、そのGFP遺伝子をGFPのdsRNAでノックダウンする系を構築した。次に、protein B2を発現するベクターを構築し、ノックダウン実験の際に同時に細胞に導入することで、GFP mRNAがレスキューされるかを検討した(図19)。その結果、protein B2の発現ベクターを導入したセクターにはGFPの蛍光シグナルが確認され、GFP mRNAもほぼインタクトの状態であった(図20)。ノダウイルスがRNA干渉作用のサプレッサーをコードすることは、魚類においてRNA干渉が重要な防御システムであることを示唆するものと思われる。
 |
 |
| 図 19 | 図 20 |